政策法規||本周重磅政策法規概覽(20.11.23-11.27)
NMPA/CDE/CFDI/藥典委公布藥品/醫療器械相關內容本周集錦。
?
NMPA
?
01
?
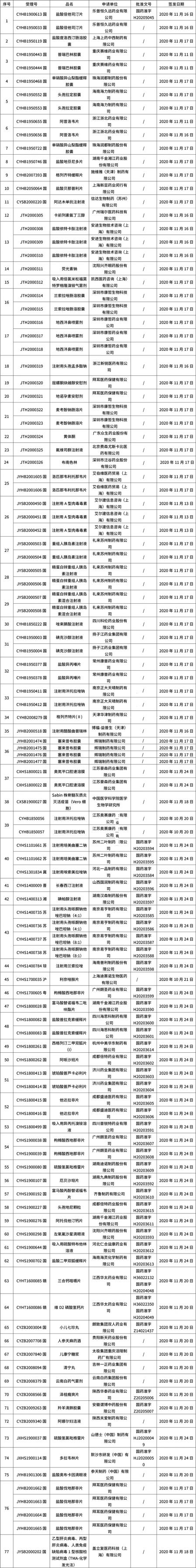
本周共計77+53個品種獲批取得藥品批準證明文件(特殊藥品批文53個),其中一致性評價品種12個。
?
?
02
?
關于發布仿制藥參比制劑目錄(第三十一批)、(第三十二批)的通告
?
兩批次共計202個品規參比制劑來源公布,其中頭孢呋辛酯片、利丙雙卡因乳膏等因持證商名稱或通用名稱變更公示。
?

掃描下方二維碼
查看詳細信息

?

掃描下方二維碼
查看詳細信息

?
03
?
關于發布真實世界數據用于醫療器械臨床評價技術指導原則(試行)的通告(2020年第77號)
?
為規范和指導真實世界數據在醫療器械臨床評價中的應用,該指導原則予以發布并執行。
?

掃描下方二維碼
查看詳細信息

?
04
?
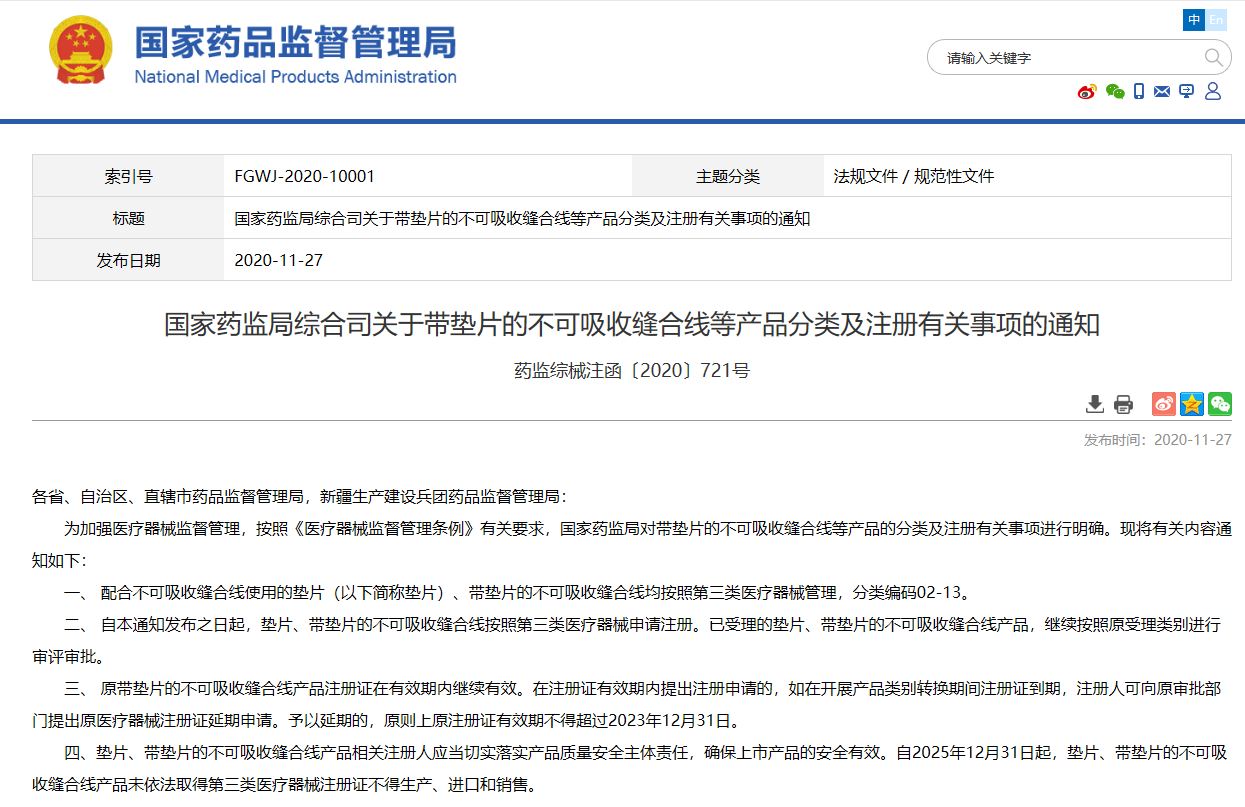
關于帶墊片的不可吸收縫合線等產品分類及注冊有關事項的通知 藥監綜械注函〔2020〕721號
?
配合不可吸收縫合線使用的墊片(以下簡稱墊片)、帶墊片的不可吸收縫合線均按照第三類醫療器械管理,分類編碼02-13。
?
掃描下方二維碼
查看詳細信息

?
CDE
?
01
?
關于發布《化學藥品創新藥I期臨床試驗申請藥學共性問題相關技術要求》和《化學藥品I期臨床試驗申請藥學研究信息匯總表(修訂版)》的通告(2020年第40號)
?
藥審中心組織制定了《化學藥品創新藥I期臨床試驗申請藥學共性問題相關技術要求》,同時對原食品藥品監管總局《關于發布〈新藥I期臨床試驗申請技術指南〉的通告》(2018年第16號)中所附《化學藥品I期臨床試驗申請藥學研究信息匯總表》進行了修訂,并于11月12日起執行。
?

掃描下方二維碼
查看詳細信息

?
02
?
關于公開征求《疫苗臨床試驗抗體分析方法研究技術指導原則》意見的通知
?
為進一步規范和指導疫苗臨床試驗抗體分析的研究,該指導原則予以意見征求,時間截至至12月23日。
?

掃描下方二維碼
查看詳細信息

?
03
?
關于發布《藥品審評中心補充資料工作程序(試行)》的通告(2020年第42號)
?
為進一步規范藥品注冊審評補充資料管理工作,結合藥品審評以流程為導向的科學管理體系的研究成果和審評工作實際,該通告自12月1日起正式執行,各申請人注意發補通知件中期限要求。
?

掃描下方二維碼
查看詳細信息

?
藥典委
?
本周奧沙拉秦鈉膠囊、阿膠益壽口服液、富馬酸替諾福韋二吡呋酯、卡培他濱片標準公示,及金銀花配方顆粒、熟地黃配方顆粒、淡竹葉配方顆粒、酒女貞子配方顆粒、淫羊藿配方顆粒、黃芪配方顆粒、炙淫羊藿配方顆粒、生地黃配方顆粒試點統一標準公示(第二次)。
?

掃描下方二維碼
查看詳細信息

?
-END-
?
關于我們:
?
? ? ? ?藥政部是隸屬于公司副總裁直接領導下的部門,以國家藥品政策為導向,以為客戶提供集藥物研發、注冊申報、現場核查等一體化專業技術服務為宗旨,以高效、成功申報項目最終目標。
?
? ? ? ?藥政部擁有一支技術與注冊經驗豐富的團隊,作為一家提供專業服務的公司,在原料藥登記、仿制藥一致性評價、仿制藥注冊、新藥注冊以及進口藥品注冊等方面均具有專業且豐富的經驗,已助力成功申報多項藥品注冊申請,在業內具有良好的口碑。
? ? ? 部門堅持 “忠誠、思考、建設、承擔、分享”的公司理念,不斷加強人才隊伍建設、提升專業能力、豐富注冊經驗、拓展業務范圍,致力于為客戶提供高效率、高質量、合規的技術服務,為保護和促進公眾健康而不懈努力。
?


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
